EverExceed hat kürzlich eine neue Niedertemperaturtechnologie vorgestellt.
Lithium-Eisenphosphat-Batterie
Diese Technologie lässt sich sogar bei unter 0 °C und im Minusbereich aufladen. In einer fünfteiligen Artikelserie werden wir die Details dieser revolutionären Technologie ausführlich beschreiben. In diesem Artikel geht es um das Funktionsprinzip der Niedertemperatur-Lithiumbatterie.
Prinzipien:
Nutzer bemängeln häufig die Leistung von Lithiumbatterien bei niedrigen Temperaturen. Die Ursache für die schlechte Tieftemperaturleistung von Lithiumbatterien lässt sich aus zwei Perspektiven erklären: Materialeigenschaften und elektrochemische Faktoren. Betrachten wir zunächst die materialtechnische Erklärung.
Die Hauptbestandteile von Elektrolyten sind cyclische und Kettenester. Diese Lösungsmittel weisen eine geringe Fließfähigkeit bei niedrigen Temperaturen auf, und einige Elektrolyte erstarren sogar teilweise bei -30 °C bis -40 °C. Dadurch verlangsamt sich die Lithiumleitfähigkeit im Elektrolyten bei niedrigen Temperaturen, was die Lade- und Entladeleistung der Batterie bei diesen Temperaturen beeinträchtigt. Die Schmelzpunkte gängiger Elektrolytlösungsmittel sind in der folgenden Abbildung aufgeführt. Lösungsmittel mit niedrigerem Schmelzpunkt eignen sich besser für den Einsatz bei niedrigen Temperaturen.
Bei den positiven und negativen Elektrodenmaterialien ist der Entladevorgang einer Lithiumbatterie der Prozess, bei dem Lithiumionen von der negativen Elektrode in die positive Elektrode eingelagert werden. Wird die Batterie bei niedriger Temperatur entladen, erhöht sich der Widerstand für die Lithiumionen-Einlagerung von der negativen zur positiven Elektrode, wodurch der Gesamtwiderstand der Reaktion steigt.
Beim Laden bei niedriger Temperatur neigt die Anode sehr stark dazu, ihren ursprünglichen Zustand beizubehalten, was den Einbau von Lithiumionen erschwert.
Am Beispiel der Entladung wurde im Kapitel über die Leistungsfähigkeit erläutert, dass die Entladespannung bei niedrigen Temperaturen deutlich geringer ist als bei normalen Temperaturen. Welches elektrochemische Prinzip liegt diesem Phänomen zugrunde? Die Antwort ist die erhöhte „Polarisation“ der Batterie bei niedrigen Temperaturen. Die Polarisation bezeichnet die Differenz zwischen der Batteriespannung und ihrem Ruhespannung (im Gebrauchszustand) während des Lade- und Entladevorgangs. Tägliches Laden und Entladen führt zu einer Polarisation der Batterie. Eine Folge der Polarisation ist eine von der Ruhespannung abweichende Spannung. Beispielsweise sinkt die Entladespannung einer Batterie mit einer Ruhespannung von 3,9 V bei Raumtemperatur und 0,5 C abrupt auf etwa 3,8 V, während sie bei niedriger Temperatur und 0,5 C abrupt auf etwa 3,7 V abfällt. Die beiden entsprechenden Spannungsdifferenzen (3,9 V - 3,8 V bei Raumtemperatur und 3,9 V - 3,7 V bei niedriger Temperatur) sind das Ergebnis der Polarisation, und die Bezeichnung für diese Spannungsdifferenz lautet Überspannung.
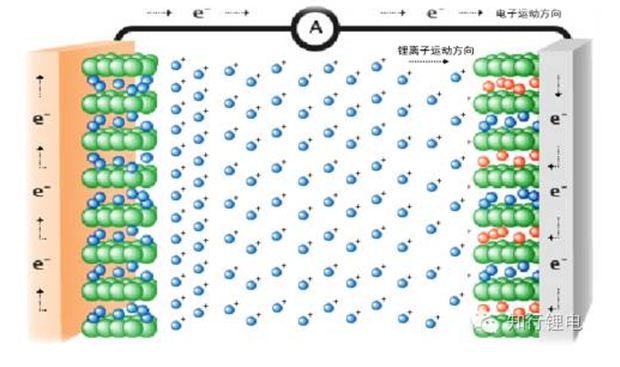
Die Polarisation in der Batterie besteht aus elektrochemischer Polarisation und Konzentrationspolarisation.
Das war’s für diesen Artikel. Zusammenfassend lässt sich sagen: Aus materialwissenschaftlicher Sicht sind die Hauptgründe für die schlechte Leistung von Lithium-Ionen-Batterien bei niedrigen Temperaturen die verringerte Ionenleitfähigkeit des Elektrolyten und der erhöhte Lithiumionenwiderstand an den positiven und negativen Elektroden. Aus elektrochemischer Sicht ist es die erhöhte Zellpolarisation bei niedrigen Temperaturen, die sich in elektrochemische und Konzentrationspolarisation unterteilen lässt.
Abschluss:
Um den Anforderungen kalter Länder gerecht zu werden, in denen Zuverlässigkeit erforderlich ist
Energiespeicherlösung
Für Anwendungen im Außenbereich arbeiteten die Forschungs- und Entwicklungsingenieure von EverExceed lange an einer passenden Lösung – und so entstand die neue Technologie. Entscheiden Sie sich daher bei Ihrer Energiespeicherlösung für kalte Temperaturen für EverExceed – eine Marke, auf die Sie sich voll und ganz verlassen können.

